En el año 1932, el químico escocés Thomas Graham (1805-1869) llevó a cabo una serie de experimentos sobre las velocidades de emisión de los gases.
Se refiere a la velocidad con los distintos gases atraviesan por ejemplo, una pared porosa. Si la temperatura es constante, la velocidad de emisión de un gas es inversamente proporcional a la raíz cuadrada de su masa molar.
La ley de Graham enuncian que la velocidad de difusión es inversamente proporcional a la densidad del gas según:
Para dos gases cualesquiera (siendo K la constante de proporcionalidad):
Dividiendo ambas expresiones:
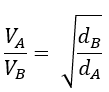
Graham dio con otra forma de calcular los pesos moleculares de los gases a partir de medidas experimentales. . Utilizando las ecuaciones de los gases ideales despejamos la densidad:
Reemplazamos la densidad de ambos gases en las ecuaciones de velocidad. Como la Presión P y la Temperatura son constantes, simplificadas, y la ecuación de Graham queda de la siguiente manera:
A cualquier temperatura y presión , la densidad y la masa molar de un gas son directamente proporcionales. Esto se puede tener en cuenta en un experimento muy sencillo que consiste en colocar en un tubo de vidrio muy limpio, en forma simultánea de tapones de algodón embebidos, uno con solución de HCl (Ácido clorhídrico) y el otro en NH 3 (Amoniaco). Al cabo de unos minutos se observa la formación de un anillo de humo blanco de NH4Cl (Cloruro de Amonio) como producto de la siguiente reacción.
HCl + NH 3 ⇒ NH 4 Cl
¿como se adaptan las ciudades al cambio climático actualmente ?
resumen
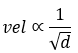
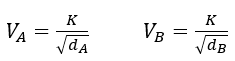
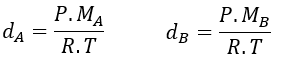
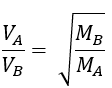








No hay comentarios:
Publicar un comentario