posiciones distintas, formando el 1-propanol (I) y el 2-propanol (II).
Segundo ejemplo
En este segundo ejemplo se observan dos isómeros estructurales de cadena o esqueleto; ambos poseen la misma fórmula (C4H10O) y el mismo sustituyente (OH), pero el isómero de la izquierda es de cadena lineal (1-butanol), mientras el de la derecha posee estructura ramificada (2-metil-2-propanol).
Tercer ejemplo
También se muestran a continuación dos isómeros estructurales de grupo funcional, donde ambas moléculas poseen exactamente los mismos átomos (con fórmula molecular C2H6O) pero su arreglo es diferente, dando como resultado un alcohol y un éter, cuyas propiedades físicas y químicas varían enormemente de un grupo funcional a otro.
Cuarto ejemplo
Asimismo, un ejemplo de tautomería es el equilibrio entre algunas estructuras con grupos funcionales C=O (cetonas) y OH (alcoholes), también llamado equilibrio ceto-enólico.
Quinto ejemplo
Seguidamente, se presentan dos isómeros geométricos cis- y trans-, observándose que el de la izquierda es el isómero cis, el cual se denota con la letra Z en su nomenclatura, y el de la derecha es el isómero trans, denotado por la letra E.
Sexto ejemplo
Ahora se muestran dos diastereómeros, donde se notan las similitudes en sus estructuras pero se puede apreciar que estas no pueden superponerse.
Séptimo ejemplo
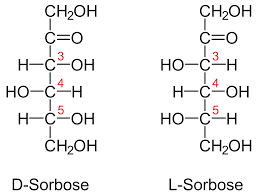
Finalmente, se observan dos estructuras de carbohidratos que son isómeros ópticos llamados enantiómeros. El de la izquierda es dextrógiro, pues polariza el plano de la luz hacia la derecha. En cambio, el de la derecha es levógiro, porque polariza el plano de la luz hacia la izquierda.
La palabra quiral fue introducida por William Thomson (Lord Kelvin) en 1894 para designar objetos que no son superponibles con su imagen especular. Aplicado a la química orgánica, podemos decir que una molécula es quiral cuando ella y su imagen en un espejo no son superponibles.
La quiralidad está a menudo asociada a la presencia de carbonos asimétricos. Un carbono asimétrico es aquel que se une a cuatro sustituyentes diferentes. Un ejemplo de carbono asimétrico lo tenemos en la molécula de Bromocloroyodometano. El carbono está unido a bromo, cloro, yodo e hidrógeno, cuatro sustituyentes diferentes que lo convierten en quiral o asimétrico. La molécula y su imagen en un espejo son diferentes, ningún giro permite superponerlas. La relación entre una molécula y su imagen especular no superponible es de enantiómeros.
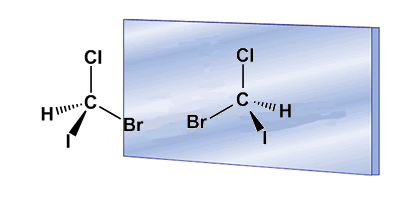
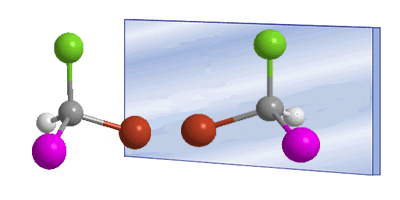
En estos dibujos podemos ver la molécula de Bromocloroyodometano y su enantiómero reflejado en el espejo.






No hay comentarios:
Publicar un comentario