lunes, 29 de abril de 2019
lunes, 8 de abril de 2019
SEMANA # 12
CONTINUACIÓN
Prefijos de los carbonos
En las siguiente tabla mostraremos los prefijos numéricos de la
cantidad de carbonos de una cadena y los prefijos para la cantidad de grupos
|
lunes, 1 de abril de 2019
SEMANA # 11
Introducción
¿Cómo se ve la gasolina que le pones a tu coche? A simple vista, es un líquido marrón amarillento poco interesante. Pero, si pudieras hacer un acercamiento al nivel molecular, notarías que en realidad está compuesto de una gama impresionante de moléculas diferentes, la mayoría de ellas hidrocarburos (moléculas que contienen únicamente carbono e hidrógeno).
Algunas serían pequeñas, con solo cuatro átomos de carbono, mientras que otras serían más grandes, con hasta doce carbonos. Algunas formarían líneas rectas, otras se ramificarían; algunas solo tendrían enlaces sencillos, mientras que otras tendrían enlaces dobles y otras más tendrían anillos, incluyendo anillos aromáticos (anillos planos con enlaces dobles alternados). Los diferentes hidrocarburos de la gasolina tienen diferentes propiedades —diferentes puntos de fusión y de ebullición, por ejemplo— y la mezcla de hidrocarburos (junto con algunas moléculas que no son hidrocarburos) le proporcionan a la gasolina las propiedades que hacen que se queme bien dentro de un motor.
¡Hay una gran diversidad de hidrocarburos!
Como muestra este ejemplo, los hidrocarburos tienen muchas estructuras diferentes. Pueden variar en longitud, ser ramificados o no ramificados, tener forma lineal o anular (o una combinación de ambas) e incluyen varias combinaciones de enlaces carbono-carbono sencillos, dobles y triples. Incluso si dos hidrocarburos tienen la misma fórmula química, sus átomos pueden estar conectados o distribuidos en el espacio de diferentes maneras, lo que los hace isómeros unos de otros (y a veces les dan propiedades muy distintas).
Todos estos tipos de diferencias estructurales afectan la forma tridimensional, o conformación, de la molécula de hidrocarburo. En el contexto de las macromoléculas (las grandes moléculas biológicas como el ADN, las proteínas y los carbohidratos), las diferencias estructurales en el esqueleto de carbono suelen repercutir en la forma en que funciona la molécula.
Ramificación, enlaces múltiples y anillos en los hidrocarburos
Las cadenas de hidrocarburos se forman por medio de una serie de enlaces entre los átomos de carbono. Pueden ser largas o cortas; por ejemplo, el etano tiene solo dos carbonos mientras que el decano tiene diez. Las cadenas con mayor número de carbonos pueden ser lineales o ramificadas. En el caso del decano, los átomos de carbono se alinean en una sola fila, pero otros hidrocarburos con la misma fórmula (C10H22C, start subscript, 10, end subscript, H, start subscript, 22, end subscript) pueden tener una cadena primaria más corta con ramas laterales (de hecho, ¡existen 75 estructuras ramificadas ligeramente distintas entre sí para la fórmula C10H22C, start subscript, 10, end subscript, H, start subscript, 22, end subscript!)
Además, los hidrocarburos pueden contener diferente número de enlaces sencillos, dobles y triples. Los hidrocarburos etano, etileno y etino proporcionan un ejemplo de cómo diferentes tipos de enlaces afectan la geometría de una molécula.
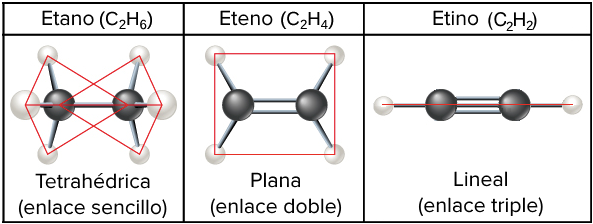
Etano: organización tetrahédrica de los sustituyentes en los enlaces alrededor de los átomos de carbono.
Etileno o eteno: estructura plana debido a la presencia de un enlace doble.
Acetileno o etino: estructura lineal debido a la presencia de un enlace triple.
Crédito de la imagen: imagen modificada de "Carbon: Figure 2 (Carbono figura 2)", de OpenStax College, Biología (CC BY 3.0).
- El etano (C2H6C, start subscript, 2, end subscript, H, start subscript, 6, end subscript), con un enlace sencillo entre los átomos de carbono, forma una figura de dos tetraedros (uno alrededor de cada carbono) y puede girar libremente alrededor del enlace carbono-carbono.
- En contraste, el enlace doble del etileno (C2H4C, start subscript, 2, end subscript, H, start subscript, 4, end subscript) le da una configuración plana (o planar) y evita la rotación alrededor del enlace carbono-carbono. Esta es una característica general de los enlaces dobles carbono-carbono, así que cada vez que veas uno de estos en una molécula, recuerda que esa parte de la molécula será plana (e incapaz de girar).
- Por último, el enlace triple del etino (C2H2C, start subscript, 2, end subscript, H, start subscript, 2, end subscript) da como resultado una forma no solo plana de la molécula, sino incluso linear.
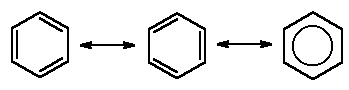
Una característica adicional que añade diversidad a las estructuras de hidrocarburos es la posibilidad de formar anillos. En los hidrocarburos se pueden encontrar anillos de varios tamaños y estos anillos también pueden tener ramificaciones o incluir enlaces dobles. Los anillos con ciertos patrones de enlaces dobles, como el anillo de benceno que se muestra a continuación, son excepcionalmente estables y adoptan una estructura planar. Estos anillos, llamados anillos aromáticos, se encuentran en algunos aminoácidos, así como también en hormonas como la testosterona y el estrógeno (las principales hormonas másculina y femenina, respectivamente).
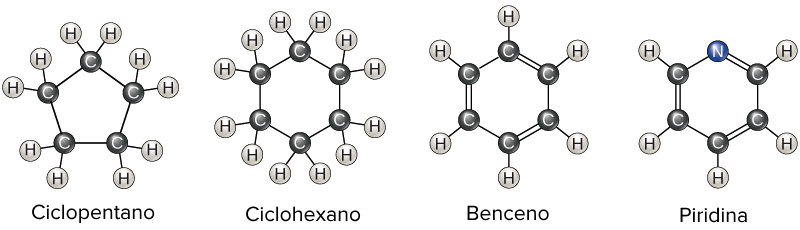
Moléculas orgánicas con estructuras anulares: ciclopentano, ciclohexano, benceno y piridina.
Crédito de la imagen: OpenStax Biología
Algunos anillos aromáticos contienen átomos distintos al carbono o hidrógeno, como el anillo de piridina que se muestra arriba. Debido a sus átomos adicionales, estos anillos no se consideran como hidrocarburos. Puedes aprender más sobre los compuestos aromáticos en la sección de química de los compuestos aromáticos.
Isómeros
El arreglo tridimensional de los átomos y sus enlaces químicos dentro de las moléculas orgánicas es crucial para entender su química. Las moléculas que tienen la misma fórmula química pero cuyos átomos están unidos de manera distinta o tienen una conformación espacial diferente, se llaman isómeros.
Isómeros estructurales
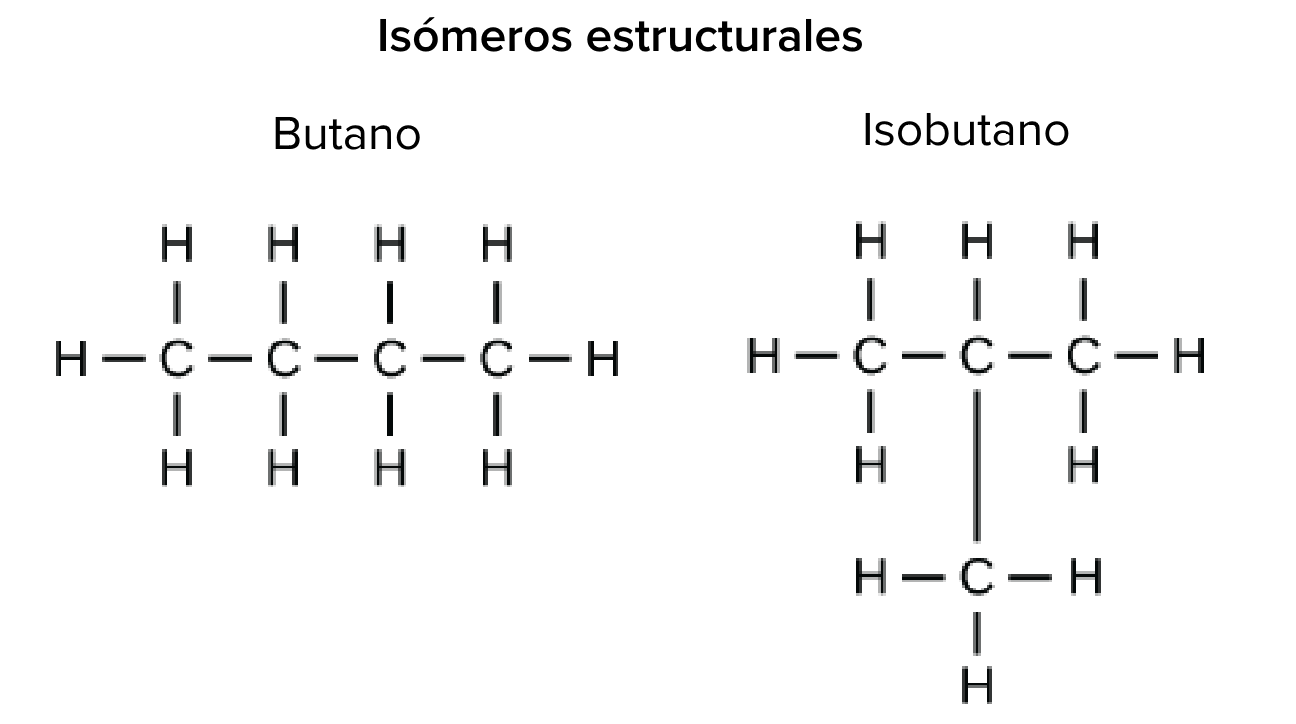
Ejemplo de isómeros estructurales: butano e isobutano.
Crédito de la imagen: imagen modificada de "Carbon: Figure 4 (Carbono figura 4)", de OpenStax College, Biología (CC BY 3.0).
Los isómeros estructurales (como el butano y el isobutano que se muestran a la derecha) tienen sus átomos unidos en diferente orden: ambas moléculas tienen cuatro carbonos y diez hidrógenos (C4H10C, start subscript, 4, end subscript, H, start subscript, 10, end subscript), pero los átomos están enlazados de manera diferente dentro de las moléculas, lo que resulta en propiedades químicas distintas (como un punto de fusión y ebullición más bajo para el isobutano). Debido a estas diferencias, el butano es un buen combustible para los encendedores y antorchas, mientras que el isobutano se utiliza como refrigerante y propulsor en las latas de aerosol.
Isómeros cis-trans (geométricos)
Por otro lado, los isómeros cis-trans (geométricos) tienen sus átomos unidos en el mismo orden, pero la configuración de los átomos alrededor de sus enlaces es diferente. La isomería _cistrans no se aplica para moléculas lineales que solo tienen enlaces carbono-carbono sencillos, puesto que estos enlaces pueden girar libremente. Sin embargo, en moléculas que tienen enlaces dobles, los átomos unidos a los carbonos del enlace se quedarán estáticos en una de dos posibles configuraciones debido a que este tipo de enlaces no puede girar. Si todos los átomos unidos son iguales, no habrá ninguna diferencia; sin embargo, si cada carbono está unido a dos átomos o grupos diferentes, son posibles dos conformaciones diferentes.
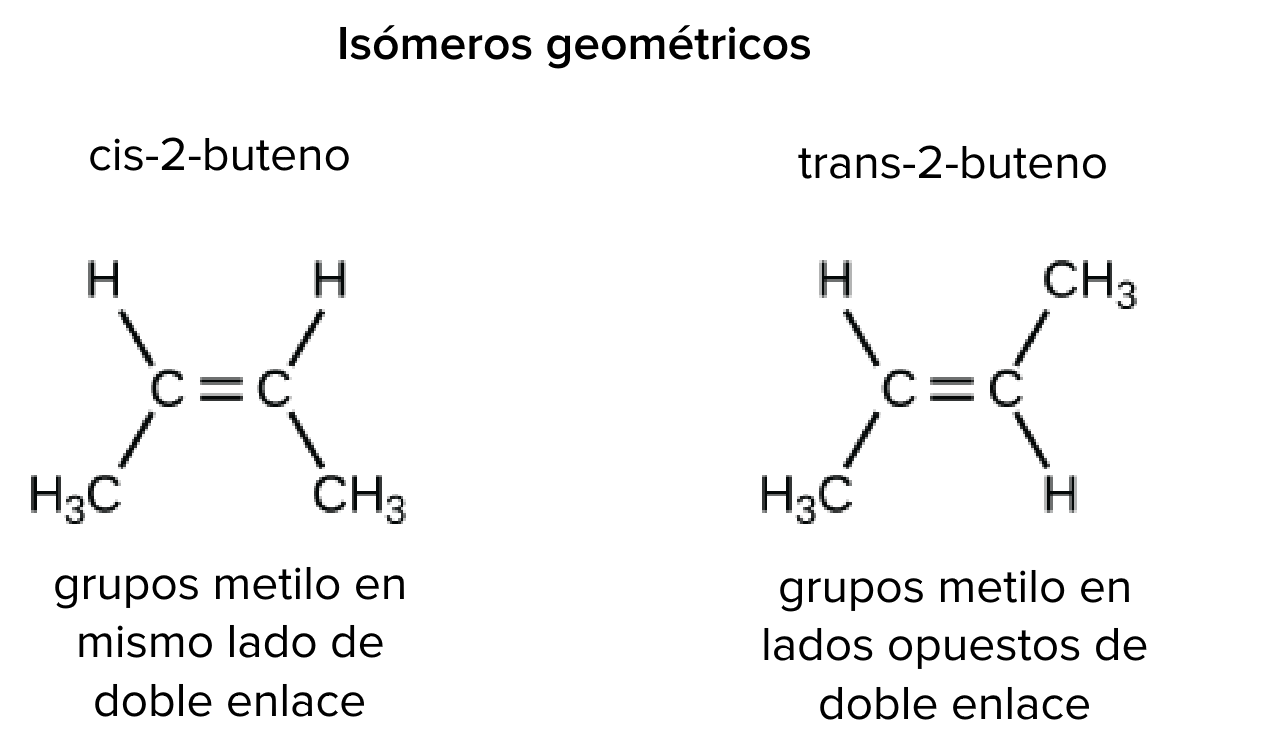

Ejemplo de isómeros geométricos: cis-2-buteno y trans_2_buteno.
Crédito de la imagen: imagen modificada de "Carbon: Figure 4 (Carbono figura 4)", de OpenStax College, Biología (CC BY 3.0).
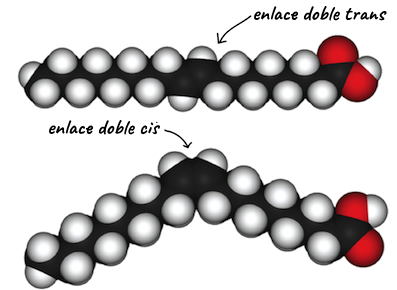
Por ejemplo, en el 2-buteno (C4H8C, start subscript, 4, end subscript, H, start subscript, 8, end subscript), los dos grupos metilo (CH3C, H, start subscript, 3, end subscript) pueden ocupar diferentes posiciones en relación con el enlace covalente doble central en la molécula. Si ambos grupos metilo están del mismo lado del enlace doble, esto se conoce como configuración cis; si están en lados opuestos, esto es la configuración trans.
En la configuración trans, los carbonos forman una estructura más o menos lineal, mientras que la configuración cis forma una curvatura en el esqueleto de carbono. (Algunas moléculas en forma de anillo también pueden tener configuraciones cis y trans, en las que los átomos unidos se conservan en los lados contiguos u opuestos del anillo).
En las grasas y aceites, las largas cadenas de carbonos conocidas como ácidos grasos pueden contener enlaces dobles, que pueden estar en configuración ciso trans (como se muestra a la derecha). Cuando algunos de estos enlaces están en la configuración cis, la curvatura resultante en el esqueleto de carbono de la cadena evita que las moléculas se junten demasiado, por lo que se mantienen en estado líquido (como aceite) a temperatura ambiente. Por otro lado, las moléculas con enlaces dobles trans (popularmente conocidas como grasas trans), tienen ácidos grasos relativamente rectos que a temperatura ambiente pueden compactarse bastante y formar grasas sólidas.
Las grasas trans se relacionan con un mayor riesgo de enfermedad cardiovascular, así que muchos fabricantes de alimentos han suprimido su uso en años recientes. Los lípidos con enlaces dobles trans se encuentran en algunos tipos de mantecas y margarinas, mientras que los lípidos con enlaces dobles en cis pueden encontrarse en aceites, como el aceite de oliva. Ve el artículo sobre los lípidos para aprender más acerca de los diferentes tipos de lípidos.
Enantiómeros
Los enantiómeros tienen la misma estructura química pero la disposición tridimensional de sus átomos es diferente, de forma que entre sí resultan imágenes en espejo el uno del otro y no son superponibles (no se alinean perfectamente). El enantiomerismo solo se observa en moléculas con carbonos asimétricos, que son átomos de carbono unidos a cuatro átomos o grupos diferentes.
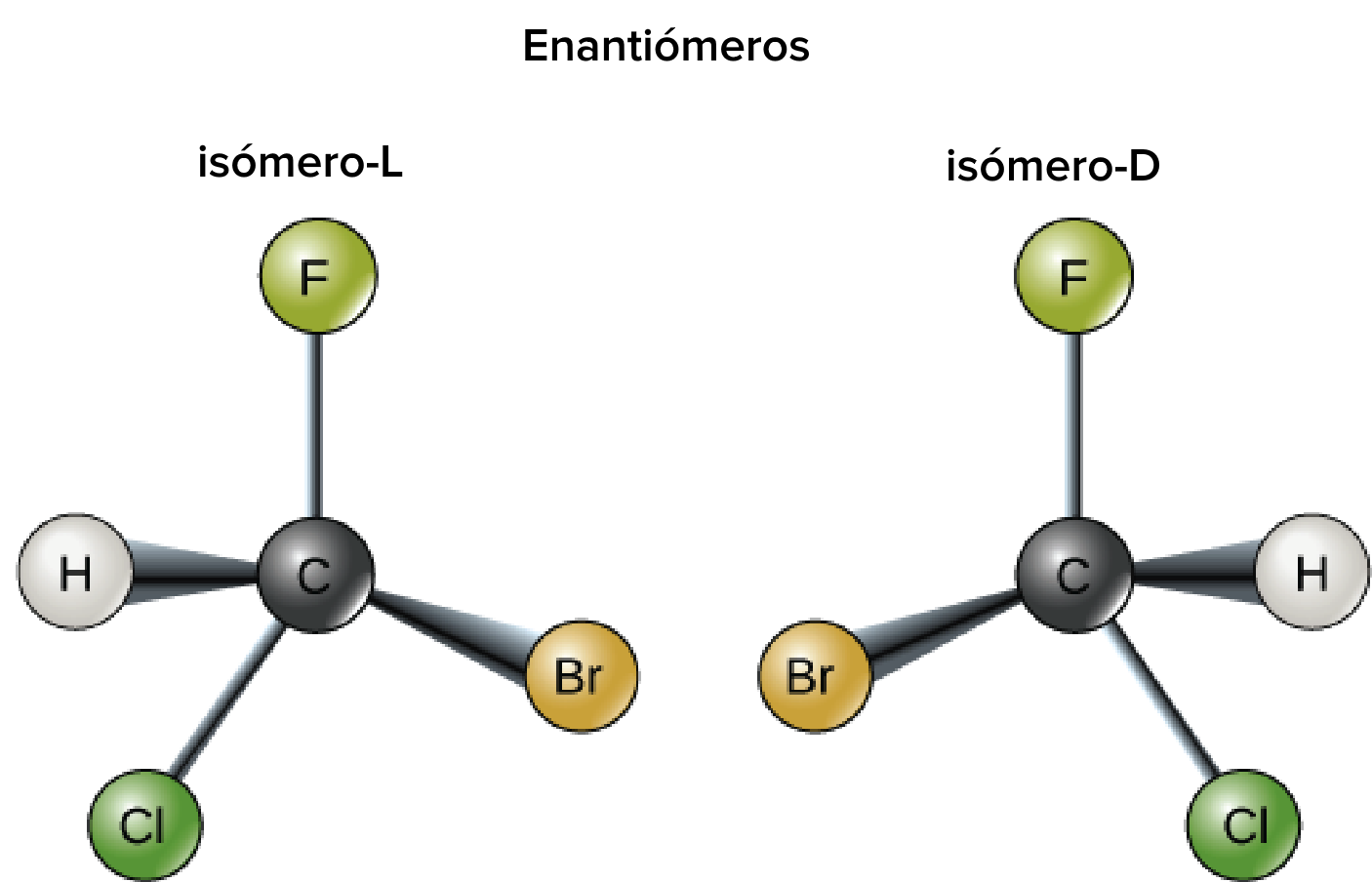
Ejemplos de enantiómeros: dos formas de CHFClBr (con el hidrógeno y los halógenos unidos a un carbono asimétrico central). Ambos son imágenes especulares que no pueden superponerse entre sí.
Crédito de la imagen: imagen modificada de "Carbon: Figure 4 (Carbono figura 4)", de OpenStax College, Biología (CC BY 3.0).
Las moléculas anteriores son un ejemplo de un par de enantiómeros. Ambas tienen la misma fórmula química y están compuestas por átomos de cloro, flúor, bromo e hidrógeno unidos a un átomo central de carbono. Sin embargo, las dos moléculas son imágenes especulares entre sí y si intentaras colocar una encima de la otra, encontrarías que no hay manera de alinearlas completamente. Los enantiómeros se suelen comparar con las manos derecha e izquierda de una persona, que también son imágenes especulares que no pueden superponerse (alinearse una sobre la otra).
Los componentes de las proteínas, los aminoácidos, también contienen un carbono asimétrico. En la imagen siguiente puedes ver modelos calotte de dos enantiómeros del aminoácido alanina. Históricamente, a los enantiómeros de los aminoácidos (y de otros compuestos) se les han dado los prefijos L y D, terminología que se sigue utilizando por los biólogos para nombrar aminoácidos y azúcares. Sin embargo, en el mundo más extenso de la química, el sistema D/L ha sido sustituído por otro sistema de nomenclatura (el sistema R/S) que es más flexible y puede utilizarse de manera más amplia. Puedes aprender más acerca de los enantiómeros y el sistema de nomenclatura R/S en la sección de química orgánica.
Suscribirse a:
Comentarios (Atom)