- Propiedades y características
- Leyes de los gases
- Aplicación de los gases
- Problemas de aplicación
- Problemas de laboratorio con gases
Esta figura muestra los cuatro estados de la materia: sólido, líquido, gaseoso y plasma. Si tomas el agua como un ejemplo de materia, los primeros tres estados son los siguientes: hielo (sólido), agua (líquido), vapor (gaseoso). El estado del plasma del agua estaba formado por los núcleos de hidrógeno y electrones.
Las estrellas están hechas de plasma, entonces plasma es la materia más abundante en el Universo.
El estado gaseoso
En el estado gaseoso de la materia, la energía de separación entre las moléculas exceden la fuerza de atracción entre ellas. Esto se traduce en una baja densidad, pocos choques y movimientos rápidos entre las moléculas que circulan libremente en todas las direcciones.
Los gases, definidos como sustancias con movilidad molecular perfecta y expansión indefinida, se caracterizan por carecer de forma y volumen debido a los espacios libres entre sus moléculas. Siendo así, los gases son fáciles de comprimir adoptando la forma de su contenedor.
Propiedades de los gases
En los gases, las fuerzas de atracción son casi inexistentes, por lo que las partículas están muy separadas unas de otras y se mueven rápidamente y en cualquier dirección, trasladándose incluso a largas distancias.
Esto hace que los gases tengan las siguientes propiedades:
1.1- No tienen forma propia
No tienen forma propia, pues se adaptan al recipiente que los contiene.
1.2- Se dilatan y contraen como los sólidos y líquidos.
1.3- Fluidez
Es la propiedad que tiene un gas para ocupar todo el espacio debido a que, prácticamente, no posee fuerzas de unión entre las moléculas que lo conforman.
Por ejemplo: Cuando hay un gas encerrado en un recipiente, como un globo, basta una pequeña abertura para que el gas pueda salir.
La presión
Los gases ejercen presión sobre cualquier superficie con la que entren en contacto, ya que las moléculas gaseosas se hallan en constante movimiento. Al estar en movimiento continuo, las moléculas de un gas golpean frecuentemente las paredes internas del recipiente que los contiene. Al hacerlo, inmediatamente rebotan sin pérdida de energía cinética, pero el cambio de dirección (aceleración) aplica una fuerza a las paredes del recipiente. Esta fuerza, dividida por la superficie total sobre la que actúa, es la presión del gas.
Definición de presión: La presión se define como una fuerza aplicada por unidad de área, es decir, una fuerza dividida por el área sobre la que se distribuye la fuerza.
Presión = Fuerza / Área
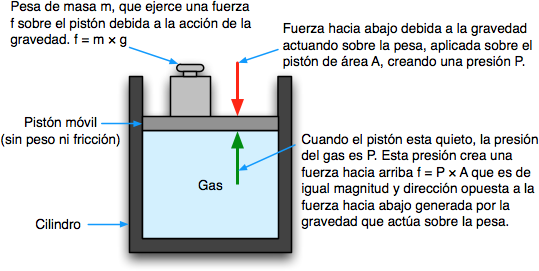
La presión de un gas se observa mediante la medición de la presión externa que debe ser aplicada a fin de mantener un gas sin expansión ni contracción.
Para visualizarlo, imaginen un gas atrapado dentro de un cilindro que tiene un extremo cerrado por en el otro un pistón que se mueve libremente. Con el fin de mantener el gas en el recipiente, se debe colocar una cierta cantidad de peso en el pistón (más precisamente, una fuerza, f) a fin de equilibrar exactamente la fuerza ejercida por el gas en la parte inferior del pistón, y que tiende a empujarlo hacia arriba. La presión del gas es simplemente el cociente f / A, donde A es el área de sección transversal del pistón.
El volumen
El volumen es el espacio que ocupa un sistema. Recuerda que los gases ocupan todo el volumen disponible del recipiente en el que se encuentran. Decir que el volumen de un recipiente que contiene un gas ha cambiado es equivalente a decir que ha cambiado el volumen del gas.
En el laboratorio se utilizan frecuentemente jeringuillas como recipientes de volumen variable cuando se quiere experimentar con gases.
Hay muchas unidades para medir el volumen. En este trabajo usaremos el litro (L) y el mililitro (mL)
Su equivalencia es:
1L = 1000 mL
Como 1 L es equivalente a 1 dm3, es decir a 1000 cm3, tenemos que el mL y el cm3 son unidades equivalentes.
La temperatura
Según la teoría cinética, la temperatura es una medida de la energía cinética media de los átomos y moléculas que constituyen un sistema. Dado que la energía cinética depende de la velocidad, podemos decir que la temperatura está relacionada con las velocidades medias de las moléculas del gas.
Hay varias escalas para medir la temperatura; las más conocidas y utilizadas son las escalas Celsius (ºC), Kelvin (K) y Fahrenheit (ºF). En este trabajo sólo utilizaremos las dos primeras.
La cantidad de gas está relacionada con el número total de moléculas que se encuentran en un recipiente. La unidad que utilizamos para medir la cantidad de gas es el mol.
Un mol es una cantidad igual al llamado número de Avogadro:
1 mol de moléculas= 6,022·1023 moléculas
1 mol de átomos= 6,022·1023 átomos
¡¡¡ 602.200.000.000.000.000.000.000 !!!
La masa molar de una sustancia pura es la masa que corresponde a 1 mol de dicha sustancia:
Con el siguiente simulador puedes calcular las masas de algunas sustancias puras como el hidrógeno, el metano, el cloro y el yodo. La medida es correcta cuando se encuentra el testigo rojo.
K
DO
Cantidad de gas
No hay comentarios:
Publicar un comentario