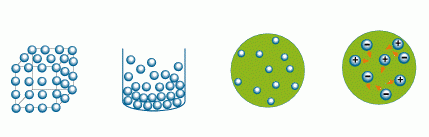
La ley combinada de los gases o la ley general de los gases es una ley de los gases que combina la ley de Boyle, la ley de Charles y la ley de Gay-Lussac. Estas leyes se han convertido en una constante. La ley de Charles establece que el volumen y la temperatura son los mismos que entre sí, siempre y cuando la presión se mantenga constante. La ley del niño afirma que la presión y el volumen son inversamente proporcionales entre sí a temperatura constante.
Finalmente, la ley de Gay-Lussac introduce una proporcionalidad directa entre la temperatura y la presión, siempre y cuando se encuentre en un volumen constante. La interdependencia de estas variables se muestra en la ley de los gases combinados.
La relación entre el producto presión-volumen y la temperatura de un sistema permanece constante.
Matemáticamente puede formularse como:
 Donde presión, volumen y temperatura se han medido en dos instantes distintos 1 y 2 para un mismo sistema.
En la adición de la ley de Avogadro al rendimiento de la ley de gases combinados se obtiene la ley de los gases ideales.
Ejemplo:
Una masa gaseosa ocupa un volumen de 2,5 litros a 12 ° C y 2 atm de presión. ¿Cuál es el volumen del gas si la temperatura aumenta a 38 ° C y la presión se incrementa hasta 2,5 atm?
identificar los datos que brinda el enunciado.
V1 = 2,5 L
T1 = 12 ° C
P1 = 2 atm
T2 = 38 ° C
P2 = 2,5 atm
Conocer la incognita.
V2 =?
Despejar V2 de la expresión
Donde presión, volumen y temperatura se han medido en dos instantes distintos 1 y 2 para un mismo sistema.
En la adición de la ley de Avogadro al rendimiento de la ley de gases combinados se obtiene la ley de los gases ideales.
Ejemplo:
Una masa gaseosa ocupa un volumen de 2,5 litros a 12 ° C y 2 atm de presión. ¿Cuál es el volumen del gas si la temperatura aumenta a 38 ° C y la presión se incrementa hasta 2,5 atm?
identificar los datos que brinda el enunciado.
V1 = 2,5 L
T1 = 12 ° C
P1 = 2 atm
T2 = 38 ° C
P2 = 2,5 atm
Conocer la incognita.
V2 =?
Despejar V2 de la expresión
 Transformar las unidades de temperatura (° C) a Kelvin.
Transformar las unidades de temperatura (° C) a Kelvin.
 Sustituir los datos en la expresión y los cálculos matemáticos.
Sustituir los datos en la expresión y los cálculos matemáticos.
 Se cancelan las unidades de presión y temperatura (atm y K), se obtiene el resultado.
Se cancelan las unidades de presión y temperatura (atm y K), se obtiene el resultado.

Ley de avogadro
La Ley de los Avances es una ley de los gases que se relaciona con el volumen y la cantidad de gas a presión y temperaturas constantes.
En 1811 Avogadro realiza los siguientes descubrimientos:
- A PRESIÓN Y TEMPERATURA Constantes, La Misma Cantidad de gas Tiene el Mismo volumen INDEPENDIENTEMENTE del Elemento químico Que Lo forme
- El volumen ( V ) es directamente proporcional a la cantidad de partículas de gas ( n )
Por lo tanto: V 1 / n 1 = V 2 / n 2
Lo que tiene como resultado que:
- Si aumenta la cantidad de gas, aumenta el volumen
- Si disminuye la cantidad de gas, disminuye el volumen
Ley de dalton
Esta ley establece como enunciado:
"La presión total de una mezcla es igual a la suma de las presiones parciales que ejercen los gases de forma independiente"
Observa la siguiente imágen, a través de la cual leyó
Activiblog: Escribe en tu cuaderno de trabajo un comentario o un análisis basado en los hechos que se evidencian en las imágenes.
De acuerdo con el enunciado de esta ley, se puede deducir la siguiente expresión matemática:
Ptotal = P 1 + P 2 + P 3 + ....
En donde: P1, P2, P3, ... = Se refiere a las presiones parciales de cada gas.
Para la presión parcial de cada gas en una mezcla, es necesario multiplicar la presión total por la fracción molar respectiva al gas. Estableciendo la siguiente expresión matemática:
Parcial = X (gas) . Ptotal X = Fracción Molar
Observa el siguiente ejemplo:
1. Una muestra de aire solo contiene nitrógeno y oxígeno gaseoso, mayores presiones parciales son 0,80 atmósfera y 0,20 atmósfera, respectivamente. Cálculo de la presión total del aire.
· Primer paso: Identificar los datos que brinda el enunciado.
P (N) = 0,80 atm
P (O) = 0,20 atm
· Segundo paso: Conocer la incógnita o interrogante.
Ptotal =?
· Tercer paso: Sustituir los datos en la expresión matemática y efectuar el cálculo.
Pt = P (N) + P (O)
Pt = 0,80 atm + 0,20 atm
Pt = 1 atm
2. Una muestra de gases contiene CH4, C2H6 y C3H8. Si la presión total es de 1,50 atm y la fracción molar de cada gas son 0,36; 0.294; 0.341; respectivamente Calcular las presiones parciales de los gases.
· Primer paso: Identificar los datos que brinda el enunciado.
X (CH4) = 0,34
X (C2H6) = 0,294
X (C3H8) = 0,341
Ptotal = 1,50 atm
· Segundo paso: Conocer la incógnita o interrogante.
P (CH4) =?
· Tercer paso: Sustituir los datos en la expresión matemática y efectuar los cálculos.
Parcial = X (gas) . Total
P (CH4) = 0,34. 1,50 atm = 0,51 atm
P (C2H6) = 0,294. 1,50 atm = 0,196 atm
P (C3H8) = 0,341. 1,50 atm = 0,512 atm





La Ley de los Avances es una ley de los gases que se relaciona con el volumen y la cantidad de gas a presión y temperaturas constantes.
En 1811 Avogadro realiza los siguientes descubrimientos:
- A PRESIÓN Y TEMPERATURA Constantes, La Misma Cantidad de gas Tiene el Mismo volumen INDEPENDIENTEMENTE del Elemento químico Que Lo forme
- El volumen ( V ) es directamente proporcional a la cantidad de partículas de gas ( n )
Por lo tanto: V 1 / n 1 = V 2 / n 2
Lo que tiene como resultado que: