Isomería: Tipos y Ejemplos de Isómeros
La isomería se refiere a la existencia de dos o más sustancias que poseen la misma fórmula molecular, pero cuya estructura es diferente en cada uno de los compuestos. En estas sustancias, conocidas como isómeros, se presentan todos los elementos en la misma proporción, pero conformando una estructuración de los átomos que es diferente en cada molécula.
La palabra isómero proviene del vocablo griego isomerès, que significa «partes iguales». Al contrario de lo que se pueda suponer, y a pesar de que contienen los mismos átomos, los isómeros pueden o no tener características similares dependiendo de los grupos funcionales presentes en su estructura.
Se conocen dos clases principales de isomería: isomería constitucional (o estructural) y estereoisomería (o isomería espacial). La isomería se presenta tanto en sustancias orgánicas (alcoholes, cetonas, entre otras) como en inorgánicas (compuestos de coordinación). Algunas veces se presentan de manera espontánea; en estos casos los isómeros de una molécula son estables y se presentan en condiciones estándar (25 °C, 1 atm), lo cual constituyó un avance muy importante en el campo de la química en el momento de su descubrimiento.
Isómeros constitucionales (estructurales)
Son aquellos compuestos que poseen los mismos átomos y grupos funcionales pero dispuestos en un orden distinto; es decir, los enlaces que conforman sus estructuras tienen un arreglo diferente en cada compuesto.
Se dividen en tres tipos: isómeros de posición, isómeros de cadena o esqueleto e isómeros de grupos funcionales, en ocasiones denominados isómeros funcionales.
Isómeros de posición
Poseen los mismos grupos funcionales, pero estos se encuentran en un lugar distinto en cada molécula.
Isómeros de cadena o esqueleto
Se distinguen por la distribución de los sustituyentes carbonados en el compuesto, es decir, por cómo se distribuyen de forma lineal o ramificada.
Isómeros de grupo funcional
También llamados isómeros funcionales, están constituidos por los mismos átomos, pero estos forman distintos grupos funcionales en cada molécula.
Tautomería
Existe una clase excepcional de isomería que se denomina tautomería, en la cual existe una interconversión de una sustancia en otra que se da generalmente por el traslado de un átomo entre los isómeros, provocando un equilibrio entre estas especies.
Estereoisómeros (isómeros espaciales)
Se denomina así a las sustancias que poseen exactamente la misma fórmula molecular y cuyos átomos están dispuestos en el mismo orden, pero cuya orientación en el espacio difiere entre una y otra. Por ello, para asegurar su correcta visualización deben representarse de manera tridimensional.
En términos generales existen dos clases de estereoisómeros: los isómeros geométricos y los isómeros ópticos.
Isómeros geométricos
Se forman mediante la ruptura de un enlace químico en el compuesto. Estas moléculas se presentan en pares que difieren en sus propiedades químicas, por lo que para diferenciarlos se establecieron los términos cis (sustituyentes específicos en posiciones adyacentes) y trans (sustituyentes específicos en posiciones contrarias de su fórmula estructural).
En este caso resaltan los diastereómeros, que poseen configuraciones diferentes y no son superponibles entre sí, cada uno con características propias. También se encuentran los isómeros conformacionales, formados por la rotación de un sustituyente en torno a un enlace químico.
Isómeros ópticos
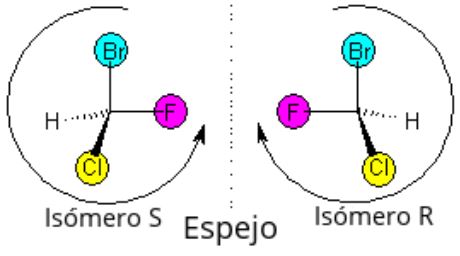
Son aquellos que constituyen imágenes especulares que no pueden superponerse; es decir, que si se coloca la imagen de un isómero sobre la imagen del otro la posición de sus átomos no concuerda de manera exacta. Sin embargo, sí poseen las mismas características, pero se diferencian por su interacción con la luz polarizada.
En este grupo destacan los enantiómeros, los cuales generan la polarización de la luz según su arreglo molecular y se distinguen como dextrógiro (si la polarización de la luz es en el sentido derecho del plano) o levógiro (si la polarización es en el sentido izquierdo del plano).
Cuando existe la misma cantidad de ambos enantiómeros (d y l) la polarización neta o resultante es cero, lo que se conoce como mezcla racémica.
Ejemplos de isómeros
Primer ejemplo
El primer ejemplo que se presenta es el de isómeros estructurales de posición, en el que se tienen dos estructuras con la misma fórmula molecular (C3H8O) pero cuyo sustituyente -OH se encuentra en dos posiciones distintas, formando el 1-propanol (I) y el 2-propanol (II).
Segundo ejemplo
En este segundo ejemplo se observan dos isómeros estructurales de cadena o esqueleto; ambos poseen la misma fórmula (C4H10O) y el mismo sustituyente (OH), pero el isómero de la izquierda es de cadena lineal (1-butanol), mientras el de la derecha posee estructura ramificada (2-metil-2-propanol).
Tercer ejemplo
También se muestran a continuación dos isómeros estructurales de grupo funcional, donde ambas moléculas poseen exactamente los mismos átomos (con fórmula molecular C2H6O) pero su arreglo es diferente, dando como resultado un alcohol y un éter, cuyas propiedades físicas y químicas varían enormemente de un grupo funcional a otro.
Cuarto ejemplo
Asimismo, un ejemplo de tautomería es el equilibrio entre algunas estructuras con grupos funcionales C=O (cetonas) y OH (alcoholes), también llamado equilibrio ceto-enólico.
Quinto ejemplo
Seguidamente, se presentan dos isómeros geométricos cis- y trans-, observándose que el de la izquierda es el isómero cis, el cual se denota con la letra Z en su nomenclatura, y el de la derecha es el isómero trans, denotado por la letra E.
Sexto ejemplo
Ahora se muestran dos diastereómeros, donde se notan las similitudes en sus estructuras pero se puede apreciar que estas no pueden superponerse.
Séptimo ejemplo
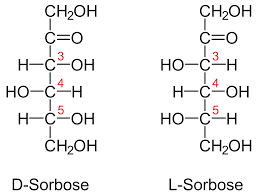
Finalmente, se observan dos estructuras de carbohidratos que son isómeros ópticos llamados enantiómeros. El de la izquierda es dextrógiro, pues polariza el plano de la luz hacia la derecha. En cambio, el de la derecha es levógiro, porque polariza el plano de la luz hacia la izquierda.